          
Chap 0: 熱力學發展史
一、簡介:
人類很早就對熱有所認識,並加以應用。但是將熱力學當成一門科學且有定量的研究,則是由17世紀末開始的,也就是在溫度計製造的技術成熟以後,才真正開啟了對熱力學的研究。
熱力學發展史,基本上就是熱力學與統計力學的發展史,約可分成四個階段:
第一個階段:17世紀末到19世紀中葉
此時期累積了大量的實驗與觀察的結果,並製造出蒸氣機,對於"熱(Heat)"的本質展開研究與爭論,為熱力學的理論建立作好了暖身。在19世紀前半葉,首先出現了卡諾理論,熱機理論(第二定律的前身)和功熱互換的原理(第一定律的基礎)。這一階段的熱力學還留在描述熱力學的現象上,並未引進任何的數學算式。
第二個階段:19世紀中到19世紀70年代末
此階段熱力學的第一定律和第二定律已完全理論化。由於功熱互換原理建立了熱力學第一定律,由第一定律和卡諾理論的結合,導致熱力學第二定律的成熟。另一方面,以牛頓力學為基礎的氣體動力論也開始發展,但這期人們並不了解熱力學與氣體動力論之間的關連。
第三個階段:19世紀70年末到20世紀初
這個時間內,首先由波茲曼將熱力學與分子動力學的理論結合,而導致統計熱力學的誕生,同時他也提出非平衡態的理論基礎,至20世紀初吉布斯(Gibbs)提出系綜理論建立統計力學的基礎。
第四個階段:20世紀30年代到今
主要是量子力學的引進而建立了量力統計力學,同時非平衡態理論更進一步的發展,形成了近代理論與實驗物理學中最重要的一環。
二、溫度計的發展:
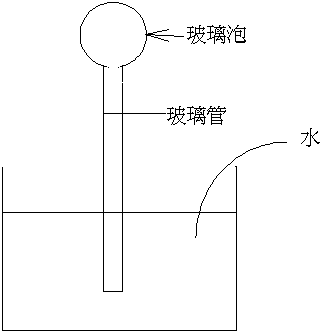
1593年:義大利伽利略建造了第一支溫度計,如上圖:
此空氣為測溫物質由玻璃泡內空氣的熱脹冷縮來指示冷暖。
1632年:法國Jean Rey,將伽利略的溫度計倒轉過來,並注入水,以水為測溫物質。利用水的熱脹冷縮來表示溫度高低,但管子是開口的,因而水會不斷蒸發。
1657年:位於義大利,佛羅倫薩的西門圖科學院的院士,改用酒精為測溫物質,並將玻璃管的開口封閉,除了避免酒精蒸發同時不受大氣壓力影響的溫度計,同時選擇了最高和最低的溫度固定點。
1659年:巴黎天文學家Boulliau將西門圖院士傳到法國的溫度計充以水銀,而製造出第一支水銀溫度計。
1660年到1700年期間:波義耳(Boyle)和其助理虎克(Hooke),甚至牛頓均體認到制定溫標的重要性,雖然他們現代溫度計沒有採用制定的溫標但他們對溫度計的發展是非常重要的。
1702年:阿蒙頓(Amontons)仿伽利略的方法製出一個裝有水銀的U型且與大氣壓力無關的氣體溫度計,與現今標準氣體溫度計相近。
1714年:Fahrenheit,荷蘭氣象學家,製作出第一批刻度可靠的溫度計(有水銀的,也有酒精的)。他選定三個溫度固定點,
(1)零度為冰水和氯化銨的混合物,
(2)32度為冰水混合的溫度。
(3)96度為人體的溫度,
這就是華氏溫標,℉。1724年他測量水的沸點為212度,同時他還證明了沸點會隨大氣壓力變化。現代人以冰在標準氣壓下的沸點標以180刻度是為華氏溫標。
1742年:瑞典天文學家Celsius,引進百分刻度法。他把水的沸點定為0度,水的冰點定為100度,此即所謂攝氏溫標。其同事Stromer將此兩溫度值倒過來即近代所用的攝氏溫標。到此為止,溫度計算是定型了。
問:近代的溫度計有那些種類呢??
三、熱量概念的演進:
人們長久以來對溫度和熱量的概念混淆不清。多數人以為物體冷熱的程度代表著物體所含熱的多寡。
首先德國Stahl教授提出熱是一種燃素,後來荷蘭Boerhaave教授甚至說熱是一種物質。雖然熱是一種物質的說法不正確,但Boerhaave教授將40℉冷水與同質量80℉熱水相混而得60℉的水,卻隱射地得到熱量守恆的一個簡單定則。不過對於不同質量,甚至不同物質的冷熱物體混合,他就難以解釋了。
另一類的人如Hooke,就認為熱是物質各部激烈的運動,牛頓也認為熱是粒子的運動。
1740年左右,俄彼得堡科學院院士克拉夫特提出冷水、熱水混合的公式,認為混合後溫度(當時稱之為熱)為
其中c1,c2為數據fitting
的係數,以當今的眼光來看,可以視為比熱。
1750年由德移民到彼得堡的Richmann院士也做了一系列熱量測的研究,他將不同溫度的水混合,研究熱量的損失,並改進克拉夫特的公式:
此公式雖不正確,但他卻指混合前後,熱量要相等的概念。[插曲,Richmann為重覆Franklin的實驗時不幸被雷打死]
1755年,Lambert院士才將熱量與溫度的概念加以區別和澄清。
真正對熱量測量工作有巨大貢獻的是英化學教授J.
Black。他不僅成功的澄清了溫度和熱量這兩個概念,同時提出相變時潛熱的概念,並暗示出不同物質具有不同的"熱容量"。而他的學生W.
Irvine正確提出熱容量的概念。
1777年化學家拉瓦錫(Lavoisier)和拉普拉斯(Laplace)設計了一個所謂拉普拉斯冰量熱器,可以正確測出熱容量和潛熱。
1784年麥哲倫(Magellan)引進比熱的術語,同一時期威爾克(Wilcke)提出若把水的比熱是為1,則可以定出其他物質的比熱。
但是在這一段期間人們依然認為拉瓦錫提出熱是一種物質是正確的。
1789年出生於美國後到英國又到德國而受封的Count
Rumford [原名Benjanin Thompson]在慕尼黑兵工廠監督大炮鑽孔,發現熱是因摩擦而產生,因斷言,熱不是物質而是來自運動。
1799年英國化學家後來的首任皇家研究院院長戴維(Davy)在維持冰點的真空中容器中進行摩擦的實驗,發現即使是兩塊冰相互摩擦也有些冰熔化成水,所以Davy認為摩擦引起物體微粒的振動,而這種振動就是熱。
雖然有Count Rumford 和Davy教授極力否定熱是一種物質說法,但是仍無法改變人們認為熱是一種物質的概念,直到19世紀中葉以後,Carnot身後50年其理論再被人們重視加上德國Mayer醫師和英國物理學家進耳(J.D.
Joule)的努力才改變了人們的觀念,促使了第一定律和第二定律成熟的產生。
四、能量守恆與功能互換:
首先談Carnot這個人。Carnot(1796-1832)祇活了36歲,活於拿破侖末期時代。1832他先患猩紅熱,又得了腦膜炎最後死於霍亂,所以幾乎所有研究資料都被燒毀了。其弟於其死後46年(1878年)將其部份手稿交給法科學院。其中他還計算熱動當量的數值,約365
kgw.m/kcal,(現今用的數值是4.187
Joule/cal),他明白指出熱不是一種物質而是一種能量的形成,雖然他是最早有熱力學中能量守恆概念的人,但由於晚了近50年,其間有J.R.
Mayer和焦耳提出功能互換的原理,故一般都不把Carnot視為能量守恆定律的創始人。且1878年時第一定律和第二定律皆已完成了。
J.R. Mayer是一德國的醫生,但對行醫興趣不大,他沒有實驗設備,更沒有從當代任何物理學家取得幫助,是一個獨立研究的工作者。1840年左右,Mayer的第一篇論文寄給德國物理年鑑,文中提出能量守恆和轉換的概念,認為運動,熱、電等都可以歸結為一種力的現象,它們有一定的規律轉換,但此論文被退回並未發表。1842年Mayer不死心又投稿到化學和藥學年鑑上,除了重述能量守恆的概念,並提出熱可以作功,功也可以產生熱的能量等價的觀念,並根據比熱實驗數據推出熱功當量
1kcal=365kgw.m ,此文也未受重視,於是1845年自費印發了第三篇論文,且明確指出是如何計算熱功當量的,是氣體在等壓膨脹過程中所作的功等於定壓下所吸數熱量與定容下所吸數的熱量之差。後來稱Cp-Cv=R
為Mayer公式。因為Mayer所用推理方法無法為當代人所習慣,同時又與焦耳發生誰是第一個發現能量守恆的人的爭議,加上兩個小孩先後夭折,一連串打擊導致精神失常,在精神病院受盡折磨。
英國J.P.焦耳(Dalton的學生),花了將近40年的時間來證明由功轉換成熱時,功和所產生熱之比是一個恆定的值,即熱功當量。從1843年發表了一系列論文描述如何測熱功當量(當時並未得到重視),到1878年得到當量值423.85
kgwm/kcal=4.154 Joule/cal與現今的標準值誤差在1%之內。
與焦耳同時期時德國Hermann Von
Helmholtz也對能量守恆和轉換定律有著名的貢獻。(原是生理學家,後成為著名數學和物理學家)。他將能量形成及守恆的概念作了一次整合。
五、第一定律的形成:
因為功能互換及能量守恆的概念在1845年左右已形成,故第一定律數學式也呼之欲出。
德國科學家R. Clausius是第一位把熱力學第一運動定律用數學形式表達出來的人。在1850年,Clausius所發表論文中,此水蒸發為例,認為物體熱量的增加量dQ等於物體中熱量的變化dH,內功的變化dJ和外功變化dW的和,即
他把物體中存在的熱,解釋成物體組成粒子的動能,溫度相關,而內功則是由粒子系統所定的狀態函數。但因不知這兩者具體表達式,而將上式寫成
Clausius沒有對U命名,次一年Lord Kelvin稱U為內能。
六、卡諾的熱機理論與第二定律的發現:
熱力學第二定律的發現與提高熱機效率的研究有密切的關係。蒸氣機在18世紀就已發明了,1765和1782年瓦特兩次改進蒸氣機的設計,但效率不高。
1824年,24歲的Carnot發表著名的論文即所謂卡諾定理,對於第二定律的熱機理論有重要地位,此論文提出可逆的理想引擎,及所謂的Carnot
Cycle,(注意Carnot此時是主張熱質說)得知理想引擎效率取決於熱質在轉移時,兩個溫度差有關。同時推論出永動機是不可能實現的,並證明此種循環是具有最大效率的循環。
在表示出第一定律的1850年Clausius論文中,他也已能量守恆和轉換的觀點重新驗證了卡諾定理,而提出第二定律。在其1854年的論文中提到"如果沒有外界作功的情況下,熱永遠不能由冷的物體傳向熱的物體"。
到了1865年第二定律概念更加成熟,熵的概念被Clausius提出,而寫出另一種形式的第二定律,對於所有可逆循環過程中
幾乎與Clauisus同時間,Lord Kelvin(原名W. Thomson愛爾蘭人)研究Carrnot
Cycle也提出第二定律,同時更由此而定出絕對溫標,又稱凱氏溫標,K。
- \pnb0. 目錄 (請用滑鼠按鍵選擇你所須要的資料)
CHAP 1: Thermodynamics
CHAP 2: Simple Thermodynamic System
CHAP 3: Work
CHAP 4: Heat and the First Law of Thermodynamics
CHAP 5: Ideal Gases
CHAP 6: Engines, Refrigerators, and the Second Law of Thermodynamics
CHAP 7: Reversibility and the Kelvin Temperature
CHAP 8: Entropy
CHAP 9: Pure Substances
| 